
Número Atômico e de Massa
Seção 2.3
Vimos que um átomo é formado por prótons, elétrons e nêutrons.
Os átomos podem ser diferenciar um dos outros pela quantidades destas partículas.
O número de prótons (carga positiva) é o mesmo de elétrons (carga negativa). Portanto, o átomo é um sistema eletricamente neutro.
Com isso, podemos diferenciar um átomo através da quantidade de prótons e nêutrons.
- número atômico: se representa pela letra Z e corresponde à carga do núcleo, ou seja, a ao número de prótons existentes no núcleo do átomo.
Z = p (número de prótons).
- número de massa: se representa pela letra A e corresponde ao número de prótons e nêutrons (n = número de nêutrons) do núcleo.
A = p + n
Logo, A = Z + n => n = A - Z
Exemplos:
hidrogêneo => Z = 1, A = 1, n = 0
hélio: Z = 2, A = 4, n = 2
urânio: Z = 92, A = 238, n = 140
Numa reação química, há um rearranjo dos elétrons dos átomos envolvidos. Porém, o número de prótons e nêutrons permanecem inalterados. Logo, suas
propriedades químicas são constantes.
Elemento Químico
Um elemento químico é o conjunto de todos os átomo que têm o mesmo número atômico. Atualmente, mais de 100 elementos químicos são conhecidos.
Para a representação dos elementos usamos a convenção da IUPAC (União Internacional de Química Pura e Aplicada).

Isótopos
Isótopos são átomos do elemento químico que possuem mesmo número, porém diferentes número de massa.
O número de prótons é o mesmo, mas a quantidade de nêutrons é diferente.
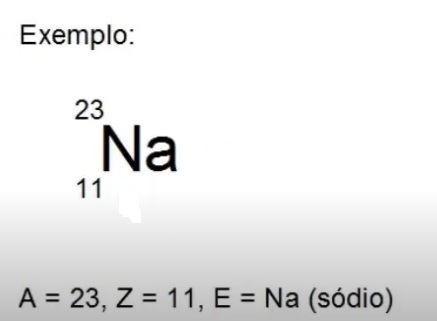
Exemplo:

Isóbaros
Isóbaros são átomos que apresentam o mesmo número de massa, mas com diferente número atômico, ou seja, elementos
químicos diferentes que apresentam o mesmo número de massa.
Exemplo:

Isótonos
Isótonos são aqueles elementos químicos que têm o mesmo nÚmero de nêutrons. Porém, seus respectivos números atômico e de massa são diferentes.
Exemplo:

Modelo atômico de Bohr-Rutherford
Para reforçar ainda mais o modelo atômico de Rutherford, o cientista dinamarquês Niels-Bohr (1885-1962) elaborou novos postulados sobre a
distribuição e o movimento dos elétrons:
- órbitas estacionárias: são aquelas que os elétrons fazem ao redor do núcleo. Têm formato circular e têm energia fixa.
- os elétrons movimentam-se sobre as órbitas circular e não emitem energia de forma espontânea.
- os elétrons ao receber energia de uma fonte externa, salta para uma outra órbita. Logo após, o elétron devolve essa energia através de
luz ou calor. A energia recebida e devolvida é igual a diferença das energias das érbitas onde ocorreu o salto.
Restrições ao modelo
Estes postulados ajudaram a compreender em muito o comportamento dos átomos, mas ainda ficaram algumas restrições:
- a energia constante do átomo ficou sem explicação.
- na verdade, o elétron não possui trajetória elíptica e circular como um satélite.
- eletrosferas com muitos átomo não são satisfatoriamente explicadas.
Ao longo dos anos, o modelo recebeu diversas correções e outros modelos surgiram. Contudo, esse modelo para estudos do Ensino Médio ainda
é o mais acessível.
Exercícios
(FEI-SP) Num exercício escolar, um professor pediu a seus alunos que imaginassem um átomo que tivesse o número atômico igual ao seu número
de chamada e o número de nêutrons 2 unidades a mais que o número de prótons. O aluno número 15 esqueceu de somar 2 para obter o número de
nêutrons e consequentemente, dois alunos imaginaram átomos isóbaros. Isso ocorreu com os alunos cujos números de chamada são:
a) 14 e 15
b) 13 e 15
c) 15 e 16
d) 12 e 15
e) 15 e 17
Resolução
O número de massa é igual ao número de prótons + número de nêutrons. A quantidade de prótons do aluno A que esqueceu os 2 nêutrons é 15 e o de
nêutrons seria 17 (15 + 2). Mas como ele esqueceu os nêutrons, seu número de massa será: A = p + n => A = 15 + 15 => A = 30.
Outro aluno B que fez o exercício corretamente também achou número de massa A = 30. Como o número de nêutrons é 2 unidades
maior que o de prótons, o restante é o número de nêutrons + número de prótons e o número de nêutrons e prótons é igual. Logo,
p + n = 30 - 2
p + n = 28
Mas p = n. Então,
p + p = 28
2p = 28
p = 28/2
p = 14
Portanto, o aluno B tem número atômico igual a 14. Então, seu número na chamada será 14.
ALTERNATIVA A
Página do Capítulo
Página do Curso
Próxima Aula
Aula Anterior
Página Principal