
Estrutura Atômica
Seção 2.2
Na aula passada, conhecemos um dos primeiros models atômicos para definir um átomo: a teoria de Dalton. No entanto, desde
a Grécia Antiga, conhecia-se a propriedade elétrica dos átomos como o experimento de se esfregar o âmbar e com ele atrair pequenas
folhas secas.
No século XVI, Benjamin Franklin constatou a existência de cargas positivas e negativas. Através do atrito de diferentes materias
verificou-se que eles se atraíam pelo fato de terem cargas opostas.
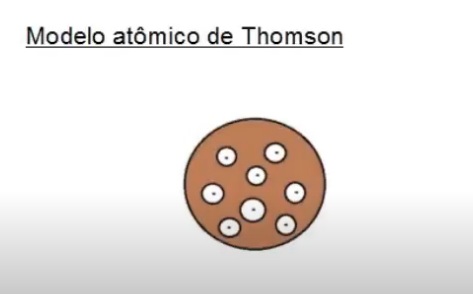
Modelo atômico de Thomson
Mas foi com o cientista Joseph John Thomson em 1897 que através de experimentos, conclui-se que o átomo é formado por partículas
de cargas negativas e que cada uma fora chamada de elétron.
Logo, o modelo de Thomson dizia que o átomo era formada por um fluido positivo onde estavam incrustradas os elétrons e com isso
ele ficaria neutro.
Em 1886, o físico alemão Eugen Goldstein descobriu uma partícula positiva no átomo e o chamou de próton.
Porém, ele só foi isolado com os experimentos dos cientistas Rutherford e Chadwick.
Radiatividade
Uma descoberta importante relativa a estrutura atômica, foi o da radiatividade. Em 1896, o francês Becquerel descobriu que o
urânio possui raios que têm alto poder de penetração. Filmes fotográficos lacrados foram sensiblizados por esses raios.
Os raios são emitidos pelos núcleos dos átomos e são chamado de alfa(α), beta(β) e gama(γ). Cada uma dessas radiações têm determinado
comportamento ao atravessar a matéria ou um campo elétrico no vácuo.
A experiência de Rutherford
Em 1911, o cientista Ernest Rutherford fez o seguinte experimento: num bloco de chumbo, colocou o elemento polônio e este
bombardeava uma lâmina de ouro com partículas alfa. Observa a figura:
Em seguidas, foi verificado que:
- a maioria das partículas alfa passava pela lâmina sem desvios.
- algumas partículas passavam, mas sofriam desvio.
- muito poucas partîculas não atravessavam a lâminas.
Essas conclusões foram possívei graças a uma tela detectora de sulfeto de zinco (ZnS) onde ocorria luminosidade.

Rutherford também observou que a lâmina de ouro funcionava como uma "peneira", pelos desvios sofridos por algumas
partículas. Logo, o átomo não seria homogêneo como supunha Dalton. Com isso, um novo modelo atômico surgiu: o átomo
nuclear que foi atribuído a Rutherford.
O modelo consistia em elétrons, prótons, núcleo e eletrosfera. Os prótons estavam no núcleo do átomo e os elétrons
na eletrosfera. Os elétrons giravam ao redor do núcleo assim como os planetas giravam em torno do Sol.

O Nêutron
Em 1932, o cientista James Chadwick descobriu partículas no interior do núcleo além dos prótons. Eles foram chamados de
nêutrons.. Estas partículas têm a mesma massa do próton e não possuem carga elétrica.

Exercícios
(ITA-SP): Considerando a experiência de Rutherford, assinale a afirmativa falsa:
a) A experiência consistiu em bombardear partículas metálicas delgadas com partículas alfa
b) Algumas partículas alfa foram desviadas de seu trajeto devido à repulsão exercida pelo núcleo positivo do metal.
c) Observado o espectro da difração das partículas alfa, Rutherford concluiu que os átomos têm densidade uniforme.
d) Essa experiência permitiu descobrir o núcleo do átomo e seu tamanho relativo.
e) Rutherford sabia antecipadamente que as partículas alfa eram carregadas positivamente.
Resolução:
Como a massa do núcleo é maior que o da eletrosfera, ele é mais denso. Logo, essa afiramação da letra c é falsa.
ALTERNATIVA C
Página do Capítulo
Página do Curso
Próxima Aula
Aula Anterior
Página Principal