
Estrutura Química
Seção 2.1
Teoria de Dalton
Desde a Grécia Antiga, a humanidade tem criado modelos para representar a matéria. O primeiro deles surgiu com os filósofos
gregos Demócrito e Leucito no ano de 450 a.C. Eles afirmaram que divindo-se a matéria diversas vezes chegar-se-á a uma unidade
tão pequena que não será mais possível haver divisão. Chamou-se essa unidade de átomo (não-divisível).
Dedpois de 2000 anos, o cientista inglês John Dalton, em sua tentativa de justificar as Leis de Lavoisier e Proust, lançou sua teoria
sobre a estrutura da matéria que ficou conhecida como teoria atômica de Dalton.
Ela tem as seguintes proposições:
- a matéria é formada por entidades extremamentes pequenas chamadas de átomo.
- os átomos são indivisíveis
- o número de diferentes átomos existentes na natureza é relativamente pequeno.
- os materias são formados por diferentes associações entre átomos iguais ou não. (atualmente esse étomos compostos são chamados de
molécula.
Elemento Químico
Os átomos que são quimicamente iguais formam um conjunto comumente chamado de elemento químico. Este pode ser representado
pela primeira letra do nome do elemento em latim ou por mais uma letra para diferenciar de outros elementos.
Exemplo:
Enxofre - nome em latim = Sulfur
Elemento químico representado pelo S.
Outros exemplos:
Au - ouro
Hg - mercúrio
H - hidrogênio
O - oxigênio
C -carbono
Pb - chumbo
Em qualquer parte do mundo, o símbolo dos elementos é sempre o mesmo.
Exemplo:
- em português: Ag (prata).
- em italiano: Ag (argenta).
- em inglês: Ag (silver).
Molécula
As moléculas são associação de átomos pertencentes a um mesmo elemento químico ou elementos diferentes.
Exemplo:
- água (H2O)
- ozônio (O3)
Subsâncias Puras Simples e Compostas
Vimos nas aulas anteriores que toda substânica pura, na sua mudança de estado, tem temperatura constante. As substâncias
puras podem ser simples e compostas.
As susbstâncias puras simples não podem ser decompostas em outras substâncias e são formadas pelo mesmo elementos químico.
Ex.: oxigênio, hidrogênio e carbono.
As substâncias puras compostas podem ser decompostas em duas ou mais substâncias por força de um agente externo como a luz,
calor, eletricidade, etc.
Ex.: água e cloreto de sódio.
Exemplo de decomposição da água:
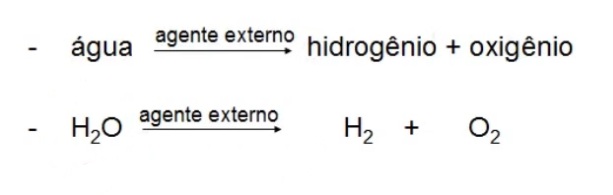
Alotropia
O carbono é uma substância pura simples. No entanto, dependendo de sua estrutura ela pode formar diferentes substâncias. O diamante
e o grafite são duas substâncias diferentes formadas por carbono.
O fenômeno onde um mesmo elemento químico forma diferentes substâncias é chamado de alotropia.
Outro exemplo: elemento oxigênio forma o oxigênio comum (O2) e o ozônio (O3).
Exercícios
(IFF-RJ): Assinale a opção que representa apenas substâncias simples:
a) H2, Cl2, N2, CH4
b) MgCl2, H2O, H2O2, CCl4
e) Na2O, NaCl, H2, O2
d) CCLH4, H2O, Cl2, HCl
e) H2, Cl2, O2, N2
Resolução:
As substâncias puras simples têm apenas um elemento químico em sua composição. Portanto, H2, Cl2, O2, N2
são substâncias simples.
ALTERNATIVA E
Página do Capítulo
Página do Curso
Próxima Aula
Aula Anterior
Página Principal