
Fenômeno e Reação Química
Seção 1.4
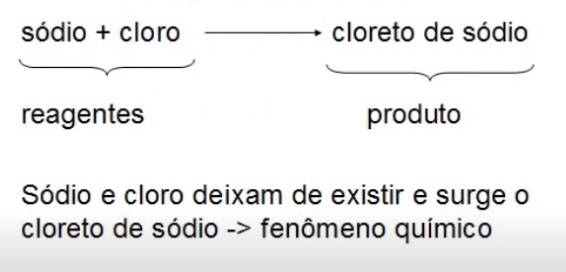
Fenômeno
Um fenômeno acontece quando num sistema acontece uma transformação, ou seja, o estado inicial é diferente do final.
Entende-se por sistema os materias que são analisados num estudo.
Os fenômenos podem ser físicos ou químicos:
- físicos: na transformação de um material não há alteração na sua constituição íntima.
A matéria é a mesma antes e depois
da transformação.
- químicos: há alteração na constituição do material numa transformação.
A matéria no estado final é diferente da do estado inicial.
Exemplos de fenômenos físicos: amassar de um papel, corte em barras de um pedaço de madeira, a vaporização da água, etc.
Exemplos de fenômenos químicos: queima do álcool, enferrujamento de um metal, fabricação do pão.
Reação Química
Todo fenômeno químico trata-se de uma reação química que pode ser representada numa equação química.

Exemplo:
Leis Ponderais das Reações Químicas
As leis ponderais relacionam as massas envolvidas numa reação química. São elas:
- Lei da Conservação da Massa
- Lei das Proporções Constantes
Lei da Conservação da Massa
Essa lei foi enunciada pelo químico francês Lavoisier em 1774 e diz o seguinte:
"Numa reação, em sistema fechado, a massa total é constante."
Ou seja, a massa antes e após a transformação química é a mesma (massa dos produtos = massa dos reagentes).
Lei da Conservação da Massa
Já a Lei das Proporções Constantes foi enunciada pelo químico também francês Joseph Proust em 1799 e diz o seguinte:
"Uma substância, independentemente do método de obtenção, apresenta os seus constituintes combinados em uma proporção, em massa
constante e definida."
Com o aprofundar das pesquisas ao longo do tempo, os químicos perceberam que a lei servia para qualquer tipo de reação química.
Logo, chegou-se a conclusão que numa reação química, as substâncias que a reagem e as que se formam estabelecem sempre uma
proporção.
Vejamos um exemplo:
1) 72g de carbono é combinado totalmente com 18g de hidrogênio, formando um composto chamado etano. Qual a composição centesimal do
etano ?
Resolução:
Passo 1: escrever a equação química:
carbono + hidrogênio ---------> etanol
Passo 2:
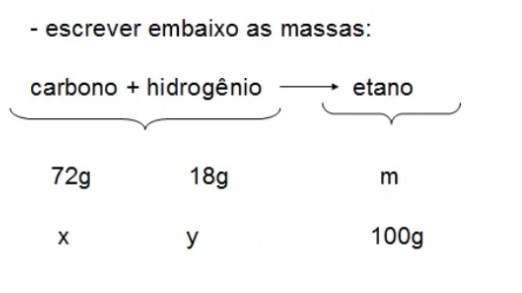
Passo 3: pela lei de Lavoisier, a massa antes e depois da reação química é a mesma. Logo,
72g(reagente) + 18g(reagente) = 90g(produto) -> 72g + 18g = 90g
Passo 4: vamos verificar a proporção de carbono no etano usando a lei de Proust:
Usando as proporçães do passo 2, temos:
72g/x = 90g/100g => 7200g2 = 90g.x = > x = 7200g2/90g => x = 80
Passo 5: vamos verificar agora a proporção de hidrogênio no etano usando a lei de Proust:
18/y = 90g/100g => 1800g2 = 90g.x => x = 1800g2/90g => y = 20
Portanto, para 100% de etano, teremos 80% de carbono e 20% de hidrogênio.
Exercício:
(FEI-SP): Assinale a alternativa que corresponde a um fenômeno químico:
a) a precipitação da chuva
b) A formação de gelo dentro do refrigerador
e) A formação de ferrugem sobre uma peça de ferro deixada ao relento.
d) A fusão do gelo.
e) A evaporação da água durante o aquecimento.
Resolução:
O único processo onde o material sofre mudança em sua composição íntima e não no seu estado físico, é a formação de
ferrugem sobre o ferro. Logo, a alternativa correta é a:
ALTERNATIVA C
Página do Capítulo
Página do Curso
Próxima Aula
Aula Anterior
Página Principal